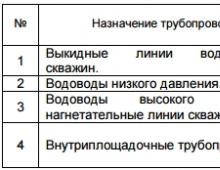
Sulamistemperatuur cu. Vase sordid - omadused, märgistus ja selle tõlgendamine. Raua keemilised omadused
Vanad kreeklased nimetasid seda elementi chalcos, ladina keeles cuprum (Cu) või aes ja keskaegsed alkeemikud nimetasid seda keemilist elementi ainult Marsiks või Veenuseks. Inimkond on vasega juba ammu tuttav, kuna looduslikes tingimustes võib seda leida tükikeste kujul, millel on sageli väga muljetavaldavad suurused.
Selle elemendi karbonaatide ja oksiidide lihtne redutseeritavus aitas kaasa asjaolule, et paljude teadlaste sõnul õppisid meie iidsed esivanemad seda maagist redutseerima enne kõiki teisi metalle.
Algul kuumutati vaskkivimid lihtsalt lahtisel tulel ja jahutati seejärel järsult. See viis nende pragunemiseni, mis võimaldas metalli taastada.
Olles omandanud nii lihtsa tehnoloogia, hakkas inimene seda järk-järgult arendama. Inimesed õppisid lõõtsa ja torude abil lõkkesse õhku puhuma, seejärel tekkis idee paigaldada tule ümber seinad. Lõpuks ehitati esimene šahtahi.
Arvukad arheoloogilised väljakaevamised on võimaldanud tuvastada ainulaadse fakti - kõige lihtsamad vasest tooted eksisteerisid juba 10. aastatuhandel eKr! Ja vaske hakati kaevandama ja aktiivsemalt kasutama 8–10 tuhande aasta pärast. Sellest ajast peale on inimkond seda paljudes aspektides (tihedus, erikaal, magnetilised omadused jne) ainulaadset keemilist elementi oma vajaduste rahuldamiseks kasutanud.
Tänapäeval on vasetükid äärmiselt haruldased. Vaske ekstraheeritakse erinevatest allikatest, mille hulgas on järgmised:

- borniit (sisaldab kuni 65% vaske);
- vase läige (tuntud ka kui kalkotsiin), mille vasesisaldus on kuni 80%;
- vaskpüriit (teisisõnu kalkoperiit), mis sisaldab umbes 30% meile huvipakkuvat keemilist elementi;
- covelliit (see sisaldab kuni 64% Cu).
Samuti ekstraheeritakse kuprit malahhiidist, kupriidist, teistest oksiidimaakidest ja peaaegu 20 seda erinevas koguses sisaldavast mineraalist.
2
IN lihtsal kujul kirjeldatud element on roosakaspunase tooniga metall, mida iseloomustab kõrge elastsus. Looduslik vask sisaldab kahte stabiilse struktuuriga nukliidi.
Positiivselt laetud vase iooni raadiusel on järgmised väärtused:
- koordinatsiooniindeksiga 6 – kuni 0,091 nm;
- indikaatoriga 2 – kuni 0,060 nm.
Ja elemendi neutraalset aatomit iseloomustab raadius 0,128 nm ja elektronide afiinsus 1,8 eV. Järjestikuse ionisatsiooni ajal on aatomi väärtused vahemikus 7,726 kuni 82,7 eV.
Cuprum on siirdemetall, seega on sellel muutuv oksüdatsiooniaste ja madal elektronegatiivsuse indeks (1,9 ühikut Paulingi skaalal). (koefitsient) on 394 W/(m*K) temperatuurivahemikus 20–100 °C. Vase elektrijuhtivus (erinäitaja) on maksimaalselt 58, minimaalselt 55,5 MS/m. Kõrgema väärtusega on ainult hõbe, teiste metallide, sealhulgas alumiiniumi elektrijuhtivus on madalam.

Vask ei saa vesinikku hapetest ja veest välja tõrjuda, kuna standardses potentsiaalireas on see vesinikust paremal. Kirjeldatud metalli iseloomustab näokeskne kuupvõre, mille suurus on 0,36150 nm. Vask keeb temperatuuril 2657 kraadi, sulab temperatuuril veidi üle 1083 kraadi ja selle tihedus on 8,92 grammi kuupsentimeetri kohta (võrdluseks alumiiniumi tihedus on 2,7).
Muud vase mehaanilised omadused ja olulised füüsikalised näitajad:
- rõhk 1628 °C juures – 1 mm Hg. Art.;
- soojuspaisumise väärtus (lineaarne) – 0,00000017 ühikut;
- venitamisel saavutatakse tõmbetugevus 22 kgf/mm2;
- vase kõvadus – 35 kgf/mm2 (Brinelli skaala);
- erikaal – 8,94 g/cm3;
- elastsusmoodul – 132000 Mn/m2;
- pikenemine (suhteline) – 60%.
Vase magnetilised omadused on mõnevõrra ainulaadsed. Element on täielikult diamagnetiline, selle magnetiline aatomtundlikkus on vaid 0,00000527 ühikut. Vase magnetilised omadused (nagu ka kõik selle füüsikalised parameetrid - kaal, tihedus jne) määravad elektritoodete valmistamise elemendi nõudluse. Alumiiniumil on ligikaudu samad omadused, nii et need ja kirjeldatud metall moodustavad "magusa paari", mida kasutatakse juhtmeosade, juhtmete ja kaablite tootmiseks.

Vase paljusid mehaanilisi omadusi (näiteks samad magnetilised omadused) on peaaegu võimatu muuta, kuid vaadeldava elemendi tõmbetugevust saab parandada külmkarastusega. IN sel juhul see kasvab ligikaudu kaks korda (kuni 420–450 MN/m2).
3
Mendelejevi süsteemi kuprum kuulub väärismetallide (IB) rühma, see on neljandas perioodis, selle aatomnumber on 29 ja sellel on kalduvus moodustada komplekse. Keemilised omadused vask pole vähem oluline kui selle magnetilised, mehaanilised ja füüsikalised omadused, olgu selleks siis kaal, tihedus või muu väärtus. Seetõttu räägime neist üksikasjalikult.
Vase keemiline aktiivsus on madal. Kuivas atmosfääris muutub vask ebaoluliselt (võib isegi öelda, et see peaaegu ei muutu). Kuid niiskuse suurenemise ja olemasolu korral keskkond süsinikdioksiid selle pinnale tekib tavaliselt rohekas kile. See sisaldab CuCO3 ja Cu(OH)2, samuti erinevaid vasksulfiidühendeid. Viimased tekivad tänu sellele, et õhus on peaaegu alati teatud kogus vesiniksulfiidi ja vääveldioksiidi. Seda rohekat kilet nimetatakse patinaks. See kaitseb metalli hävimise eest.

Kui vaske õhu käes kuumutada, algavad selle pinnal oksüdatsiooniprotsessid. Temperatuuridel 375–1100 kraadi moodustub oksüdatsiooni tulemusena kahekihiline katlakivi ja temperatuuril kuni 375 kraadi vaskoksiid. Tavalistel temperatuuridel täheldatakse tavaliselt Cu ja märja kloori kombinatsiooni (selle reaktsiooni tulemuseks on kloriidi ilmumine).
Vask suhtleb üsna kergesti ka halogeenrühma teiste elementidega. See süttib väävliaurus, kõrge tase Sellel on ka afiinsus seleeni suhtes. Kuid Cu ei ühine süsiniku, lämmastiku ja vesinikuga isegi kõrgetel temperatuuridel. Kui vaskoksiid puutub kokku väävelhappega (lahjendatud), saadakse vasksulfaat ja puhas vask; vesinikjodiid- ja vesinikbromiidhappega saadakse vastavalt vaskjodiid ja bromiid.
Kui oksiid kombineeritakse ühe või teise leelisega, on keemilise reaktsiooni tulemuseks kupraat. Kuid kõige kuulsamad redutseerivad ained (süsinikoksiid, ammoniaak, metaan ja teised) suudavad taastada vase vabasse olekusse.

Praktilist huvi pakub selle metalli võime reageerida rauasooladega (lahuse kujul). Sel juhul registreeritakse raua redutseerimine ja Cu üleminek lahusesse. Seda reaktsiooni kasutatakse eemaldamiseks dekoratiivesemed pritsitud vasekiht.
Ühe- ja kahevalentses vormis on vask võimeline looma kõrge stabiilsustasemega keerulisi ühendeid. Need ühendid hõlmavad ammoniaagi segusid (need pakuvad huvi tööstusettevõtted) ja topeltsoolad.
4
Alumiiniumi ja vase peamine kasutusvaldkond on ehk kõigile teada. Neid kasutatakse mitmesuguste kaablite, sealhulgas toitekaablite valmistamiseks. Seda soodustab alumiiniumi ja vase madal takistus ning nende eriline magnetiline võime. Elektriajamite mähistes ja trafodes (võimsus) kasutatakse laialdaselt vasktraate, mida iseloomustab nende tootmise tooraineks oleva vase ainulaadne puhtus. Kui lisada nii puhtale toorainele ainult 0,02 protsenti alumiiniumi, väheneb toote elektrijuhtivus 8–10 protsenti.

Cu, millel on suur tihedus ja tugevus ning väike kaal, sobib suurepäraselt töötlemiseks. See võimaldab meil toota suurepäraseid vasktorusid, mis demonstreerivad oma kõrgeid tööomadusi gaasi-, kütte- ja veevarustussüsteemides. Paljudes Euroopa riikides kasutatakse vasktorusid valdavas enamuses elamute ja haldushoonete sisemiste tehnovõrkude korrastamiseks.

Oleme palju rääkinud alumiiniumi ja vase elektrijuhtivuse kohta. Ärgem unustagem ka viimase suurepärast soojusjuhtivust. See omadus võimaldab kasutada vaske järgmistes struktuurides:
- soojustorudes;
- personaalarvutite jahutites;
- küttesüsteemides ja õhkjahutussüsteemides;
- soojusvahetites ja paljudes teistes soojust eemaldavates seadmetes.
Vasematerjalide ja -sulamite tihedus ja kerge kaal on kaasa toonud ka nende laialdase kasutuse arhitektuuris.
5
On selge, et vase tihedus, selle kaal ja kõikvõimalikud keemilised ja magnetilised näitajad ei paku tavainimesele suurt huvi. Kuid paljud inimesed tahavad teada vase raviomadusi.
Vanad indiaanlased kasutasid vaske silmade ja erinevate nahahaiguste raviks. Vanad kreeklased kasutasid vaskplaate haavandite, tugevate tursete, verevalumite ja muljumiste ning ka raskemate haiguste (mandlite põletikud, kaasasündinud ja omandatud kurtus) ravimiseks. Ja idas kasutati jalgade ja käte luumurdude taastamiseks vees lahustatud punast vasepulbrit.

Vase raviomadused olid venelastele hästi teada. Meie esivanemad kasutasid seda ainulaadset metalli koolera, epilepsia, polüartriidi ja radikuliidi raviks. Praegu kasutatakse raviks tavaliselt vaskplaate, mis kantakse spetsiaalsetesse inimkeha punktidesse. Vase raviomadused sellises ravis avalduvad järgmiselt:

- suureneb inimkeha kaitsepotentsiaal;
- nakkushaigused ei ole ohtlikud neile, keda ravitakse vasega;
- Valu väheneb ja põletikust vabanemine väheneb.
Vase ajalugu
Vaske nimetatakse üheks esimeseks metalliks, mida inimene iidsetel aegadel valdas ja kasutab seda tänapäevani. Vase kaevandamine oli taskukohane, sest maak tuli sulatada suhteliselt madalal temperatuuril. Esimene maak, millest hakati vaske kaevandama, oli malahhiidimaak (kalorisaator). Kiviaeg inimkonna ajaloos muutus täpselt vask, kui vasest valmistatud majapidamistarbed, tööriistad ja relvad levisid enim.
Vask on keemiliste elementide perioodilisuse tabeli D.I IV perioodi XI rühma element. Mendelejevi aatomnumber on 29 ja aatommass 63,546. Aktsepteeritud nimetus on Cu(ladina keelest Cuprum).
Looduses olemine
Vask on üsna laialdaselt esindatud maakoores, settekivimites, mere- ja magevetes ning kildades. Levitatakse nii ühenduste kujul kui ka iseseisva versioonina.
Füüsilised ja keemilised omadused
Vask on plastiline, nn siirdemetall ja sellel on kuldroosa värvus. Õhuga kokkupuutel moodustub vase pinnale oksiidkile, mis annab metallile kollakaspunase varjundi. Peamised vasesulamid on teada - tsingiga (messing), tinaga (pronks), nikliga (kupronikkel).
Igapäevane vasevajadus
Täiskasvanu vase vajadus on 2 mg päevas (umbes 0,035 mg 1 kg kehakaalu kohta).
Vask on keha jaoks üks olulisemaid mikroelemente, seega peaksid vaserikkad toidud olema igaühe toidulaual. See:
- pähklid, teraviljad,
- kala,
- teravili (eriti ja),
- Piimatooted
- , marjad ja
Vasepuuduse tunnused
Keha ebapiisava vasesisalduse tunnused on: aneemia ja halb hingamine, isutus, maoärritus, närvilisus, depressioon, väsimus, naha ja juuste pigmentatsioonihäired, haprus ja juuste väljalangemine, nahalööbed, sagedased infektsioonid. . Võimalik sisemine verejooks.
Üleliigse vase märgid
Vase liigset kogust iseloomustavad unetus, ajutegevuse häired, epilepsia ja menstruaaltsükli probleemid.
Suhtlemine teistega
Eeldatakse, et vask ja vask konkureerivad seedetraktis imendumise ajal üksteisega, seega võib ühe elemendi liig toidus põhjustada teise elemendi defitsiidi.
Vasel on suur tähtsus rahvamajanduses, selle peamine kasutusala on elektrotehnika, kuid metalli kasutatakse laialdaselt müntide vermimisel, sageli kunstiteostes. Vaske kasutatakse ka meditsiinis, arhitektuuris ja ehituses.

Vase kasulikud omadused ja selle mõju organismile
Vajalik organismi muundamiseks hemoglobiiniks. Võimaldab kasutada aminohapet türosiini, võimaldades sellel avaldada mõju juuste ja naha pigmentatsiooni tegurina. Pärast vase imendumist soolestikku transporditakse see albumiini abil maksa. Vask osaleb ka kasvu- ja paljunemisprotsessides. Osaleb kollageeni ja elastiini moodustumisel ning endorfiinide – “õnnehormoonide” sünteesis.
Looduses üsna suurte tükikestena esineva vase omadusi uuriti juba ammustel aegadel, mil sellest metallist ja selle sulamitest valmistati nõusid, relvi, ehteid jne. erinevaid tooteid majapidamises kasutamiseks. Selle metalli aktiivne kasutamine paljude aastate jooksul on tingitud mitte ainult selle erilistest omadustest, vaid ka töötlemise lihtsusest. Karbonaatide ja oksiididena maagis esinev vask on üsna kergesti redutseeritav, mida meie muistsed esivanemad ka tegema õppisid.
Esialgu tundus selle metalli taaskasutamise protsess väga primitiivne: vasemaak lihtsalt kuumutati tulel ja seejärel jahutati järsult, mis viis maagi tükkide pragunemiseni, millest vaske sai juba ammutada. Selle tehnoloogia edasiarendamine viis selleni, et tulekahjudesse hakati puhuma õhku: see tõstis maagi kuumenemistemperatuuri. Seejärel hakati maaki kuumutama spetsiaalsetes konstruktsioonides, millest said esimesed šahtahjude prototüübid.
Seda, et inimkond on vaske kasutanud iidsetest aegadest, annavad tunnistust arheoloogilised leiud, mille tulemusena leiti sellest metallist valmistatud tooteid. Ajaloolased on kindlaks teinud, et esimesed vasest tooted ilmusid juba 10. aastatuhandel eKr ning kõige aktiivsemalt hakati seda kaevandama, töötlema ja kasutama 8–10 tuhat aastat hiljem. Loomulikult ei olnud selle metalli sellise aktiivse kasutamise eelduseks mitte ainult selle maagist ekstraheerimise suhteline lihtsus, vaid ka ainulaadsed omadused: erikaal, tihedus, magnetilised omadused, elektri- ja erijuhtivus jne.
Tänapäeval on seda juba tükkide kujul raske leida, tavaliselt kaevandatakse seda maagist, mis jaguneb järgmisteks tüüpideks.
- Borniit - see maak võib sisaldada kuni 65% vaske.
- Kalkotsiit, mida nimetatakse ka vase läikeks. Selline maak võib sisaldada kuni 80% vaske.
- Vaskpüriit, mida nimetatakse ka kalkopüriidiks (sisaldus kuni 30%).
- Covelline (sisaldus kuni 64%).

Vaske saab eraldada ka paljudest teistest mineraalidest (malahhiit, kupriit jne). Need sisaldavad seda erinevates kogustes.
Füüsikalised omadused
Puhtal kujul on vask metall, mille värvus võib varieeruda roosast punaseni.
Positiivse laenguga vase ioonide raadius võib võtta järgmisi väärtusi:
- kui koordinatsiooniindeks vastab 6 - kuni 0,091 nm;
- kui see indikaator vastab 2-le - kuni 0,06 nm.
Vase aatomi raadius on 0,128 nm ja seda iseloomustab ka elektronide afiinsus 1,8 eV. Kui aatom on ioniseeritud, võib see väärtus olla vahemikus 7,726 kuni 82,7 eV.
Vask on siirdemetall, mille elektronegatiivsuse väärtus on 1,9 Paulingi skaalal. Lisaks võib selle oksüdatsiooniaste omandada erinevaid väärtusi. Temperatuurivahemikus 20–100 kraadi on selle soojusjuhtivus 394 W/m*K. Vase elektrijuhtivus, mida edestab vaid hõbe, jääb vahemikku 55,5–58 MS/m.
Kuna potentsiaalireas olev vask asub vesinikust paremal, ei saa see seda elementi veest ja erinevatest hapetest välja tõrjuda. Selle kristallvõre on kuubikujuline näokeskne, selle väärtus on 0,36150 nm. Vask sulab temperatuuril 1083 kraadi ja selle keemistemperatuur on 26570. Vase füüsikalised omadused määrab ka selle tihedus, mis on 8,92 g/cm3.

Selle mehaanilistest omadustest ja füüsikalistest näitajatest väärib märkimist ka järgmine:
- termiline lineaarpaisumine - 0,00000017 ühikut;
- tõmbetugevus, millele vasktooted vastavad, on 22 kgf / mm2;
- vase kõvadus Brinelli skaalal vastab väärtusele 35 kgf / mm2;
- erikaal 8,94 g/cm3;
- elastsusmoodul on 132000 Mn/m2;
- pikenemise väärtus on 60%.
Selle täiesti diamagnetilise metalli magnetilisi omadusi võib pidada täiesti ainulaadseks. Just need omadused koos füüsikaliste parameetritega: erikaal, erijuhtivus ja teised selgitavad täielikult selle metalli laialdast nõudlust elektritoodete tootmisel. Sarnaste omadustega on alumiinium, mida kasutatakse edukalt ka erinevate elektritoodete valmistamisel: juhtmed, kaablid jne.
Peamist osa vase omadustest on peaaegu võimatu muuta, välja arvatud selle tõmbetugevus. Seda omadust saab parendada peaaegu kaks korda (kuni 420–450 MN/m2). tehnoloogiline toimimine, nagu kõvenemine.
Keemilised omadused
Keemilised omadused Vase määrab tema asukoht perioodilisuse tabelis, kus selle järjekorranumber on 29 ja see asub neljandas perioodis. Tähelepanuväärne on see, et see kuulub väärismetallidega ühte rühma. See kinnitab veel kord selle keemiliste omaduste unikaalsust, millest tuleks täpsemalt rääkida.

Madala õhuniiskuse tingimustes ei avalda vask praktiliselt mingit keemilist aktiivsust. Kõik muutub, kui toode asetatakse tingimustesse, mida iseloomustab kõrge õhuniiskus ja kõrge süsinikdioksiidi sisaldus. Sellistes tingimustes algab vase aktiivne oksüdatsioon: selle pinnale moodustub rohekas kile, mis koosneb CuCO3-st, Cu(OH)2-st ja erinevatest väävliühenditest. See film, mida nimetatakse patinaks, esitab oluline funktsioon kaitsta metalli edasise hävimise eest.
Oksüdatsioon hakkab aktiivselt toimuma toote kuumutamisel. Kui metalli kuumutada temperatuurini 375 kraadi, siis moodustub selle pinnale vaskoksiid, kui kõrgem (375-1100 kraadi), siis kahekihiline.
Vask reageerib üsna kergesti elementidega, mis kuuluvad halogeenrühma. Kui metall asetada väävliauru sisse, siis see süttib. Kõrge aste Samuti näitab ta üles sugulust seleeniga. Vask ei reageeri lämmastiku, süsiniku ja vesinikuga isegi kõrgel temperatuuril.
Tähelepanu väärib vaskoksiidi koostoime erinevate ainetega. Seega, kui see reageerib väävelhappega, moodustub sulfaat ja puhas vask, vesinikbromiid- ja vesinikjodiidhappega - vaskbromiid ja jodiid.
Vaskoksiidi reaktsioonid leelistega, mille tulemusena moodustub kupraat, näevad välja erinevad. Vase tootmine, mille käigus metall redutseeritakse vabasse olekusse, toimub süsinikmonooksiidi, ammoniaagi, metaani ja muude materjalide abil.
Rauasoolade lahusega suhtlemisel läheb vask lahusesse ja raud redutseerub. Seda reaktsiooni kasutatakse erinevatelt toodetelt sadestunud vasekihi eemaldamiseks.
Ühe- ja kahevalentne vask on võimeline looma keerulisi ühendeid, mis on väga stabiilsed. Sellised ühendid on vase topeltsoolad ja ammoniaagisegud. Mõlemad on leidnud laialdast rakendust erinevates tööstusharudes.

Vase rakendused
Vase, aga ka sellega oma omadustelt kõige sarnasema alumiiniumi kasutamine on üldtuntud - see on tootmine kaablitooted. Vasktraate ja -kaableid iseloomustab madal elektritakistus ja erilised magnetilised omadused. Kaablitoodete tootmiseks kasutatakse kõrge puhtusastmega vase liike. Kui selle koostisesse lisada kasvõi vähesel määral võõrmetalli lisandeid, näiteks ainult 0,02% alumiiniumi, siis algmetalli elektrijuhtivus väheneb 8–10%.
Madal ja selle suur tugevus, samuti järeleandmisvõime erinevat tüüpi mehaaniline töötlemine - need on omadused, mis võimaldavad sellest toota torusid, mida kasutatakse edukalt gaasi, kuuma ja külma vee ning auru transportimiseks. Pole juhus, et neid torusid kasutatakse enamikus Euroopa riikides elu- ja haldushoonete insener-kommunikatsiooni osana.
Vask, lisaks erakordselt kõrgele elektrijuhtivusele, eristub selle võimega soojust hästi juhtida. Tänu sellele omadusele kasutatakse seda edukalt järgmiste süsteemide osana.
§1. Lihtaine keemilised omadused (st. ca = 0).
a) Seos hapnikuga.
Erinevalt oma alarühma naabritest - hõbedast ja kullast - reageerib vask hapnikuga otse. Vase aktiivsus hapniku suhtes on ebaoluline, kuid niiskes õhus oksüdeerub see järk-järgult ja kattub aluselistest vaskkarbonaatidest koosneva roheka kilega:
Kuivas õhus toimub oksüdatsioon väga aeglaselt ja vase pinnale moodustub õhuke vaskoksiidi kiht:
Väliselt vask ei muutu, kuna vaskoksiid (I), nagu ka vask ise, on roosa. Lisaks on oksiidikiht nii õhuke, et laseb läbi valgust, s.t. kumab läbi. Vask oksüdeerub erinevalt kuumutamisel näiteks temperatuuril 600-800 0 C. Esimestel sekunditel toimub oksüdatsioon vask(I)oksiidiks, mis pinnalt muutub mustaks vask(II)oksiidiks. Moodustub kahekihiline oksiidkate.
Q moodustumine (Cu 2 O) = 84935 kJ.

Joonis 2. Vaskoksiidi kile struktuur.
b) Koostoime veega.
Vase alamrühma metallid on elektrokeemilise pingerea lõpus, vesinikiooni järel. Seetõttu ei saa need metallid vesinikku veest välja tõrjuda. Samal ajal võivad vesinik ja muud metallid vase alarühma metalle nende soolade lahustest välja tõrjuda, näiteks:
See reaktsioon on redoksreaktsioon, kuna elektronid kanduvad üle:
Molekulaarne vesinik tõrjub suurte raskustega välja vase alarühma metalle. Seda seletatakse sellega, et vesinikuaatomite vaheline side on tugev ja selle lõhkumisele kulub palju energiat. Reaktsioon toimub ainult vesinikuaatomitega.
Hapniku puudumisel vask veega praktiliselt ei suhtle. Hapniku juuresolekul reageerib vask aeglaselt veega ja kaetakse rohelise vaskhüdroksiidi ja aluselise karbonaadi kilega:
c) Koostoime hapetega.
Olles pingereas pärast vesinikku, ei tõrju vask seda hapetest välja. Seetõttu ei avalda vesinikkloriid ja lahjendatud väävelhape vasele mingit mõju.
Kuid hapniku juuresolekul lahustub vask nendes hapetes, moodustades vastavad soolad:
Ainus erand on vesinikjodiidhape, mis reageerib vasega, vabastades vesiniku ja moodustades väga stabiilse vase (I) kompleksi:
2 Cu + 3 TERE → 2 H[ CuI 2 ] + H 2
Vask reageerib ka oksüdeerivate hapetega, näiteks lämmastikhappega:
Cu + 4HNO 3( konts. .) → Cu(NO 3 ) 2 +2 EI 2 +2H 2 O
3Cu + 8HNO 3( lahjendamine .) → 3Cu(NO 3 ) 2 +2NO+4H 2 O
Ja ka kontsentreeritud külma väävelhappega:
Cu+H 2 NII 4 (konts.) → CuO + SO 2 +H 2 O
Kuuma kontsentreeritud väävelhappega :
Cu+2H 2 NII 4( konts. ., kuum ) → CuSO 4 + NII 2 + 2H 2 O
Veevaba väävelhappega temperatuuril 200 0 C moodustub vask(I)sulfaat:
2Cu + 2H 2 NII 4( veevaba .) 200 °C → Cu 2 NII 4 ↓+SO 2 + 2H 2 O
d) Seos halogeenide ja mõne muu mittemetalliga.
Q moodustumine (CuCl) = 134300 kJ
Q moodustumine (CuCl 2) = 111700 kJ
Vask reageerib hästi halogeenidega ja toodab kahte tüüpi halogeniide: CuX ja CuX 2 .. Toatemperatuuril halogeenidega kokkupuutel nähtavaid muutusi ei toimu, vaid pinnale tekib esmalt adsorbeerunud molekulide kiht ja seejärel õhuke halogeniidide kiht. . Kuumutamisel toimub reaktsioon vasega väga ägedalt. Kuumutame vasktraadi või fooliumi ja langetame selle kuumalt klooripurki - vase lähedale ilmuvad pruunid aurud, mis koosnevad vask(II)kloriidist CuCl 2 ja vask(I)kloriidi CuCl lisandist. Reaktsioon toimub spontaanselt vabaneva soojuse tõttu. Mitmevalentsed vaskhalogeniidid saadakse vaskmetalli reageerimisel vaskhalogeniidi lahusega, näiteks:
Sel juhul sadeneb monokloriid lahusest valge sademe kujul vase pinnal.
Samuti reageerib vask kuumutamisel (300-400 °C) üsna kergesti väävli ja seleeniga:
2Cu +S→Cu 2 S
2Cu +Se→Cu 2 Se
Kuid vask ei reageeri vesiniku, süsiniku ja lämmastikuga isegi kõrgel temperatuuril.
e) Koostoime mittemetallide oksiididega
Kuumutamisel võib vask mõnest mittemetallioksiidist (näiteks väävel(IV)oksiid ja lämmastikoksiidid (II,IV)) välja tõrjuda lihtsaid aineid, moodustades seeläbi termodünaamiliselt stabiilsema vask(II)oksiidi:
4Cu+SO 2 600-800°C →2CuO + Cu 2 S
4Cu+2NO 2 500-600°C → 4 CuO + N 2
2 Cu+2 EI 500-600° C →2 CuO + N 2
§2. Ühevalentse vase keemilised omadused (st. ok. = +1)
IN vesilahused Cu+ ioon on väga ebastabiilne ja ebaproportsionaalne:
Cu + ↔ Cu 0 + Cu 2+
Oksüdatsiooniastmes (+1) vaske saab aga stabiliseerida väga madala lahustuvusega ühendites või kompleksi moodustamise teel.
a) vaskoksiid (I) Cu 2 O
Amfoteerne oksiid. Pruunpunane kristalne aine. Looduses esineb seda mineraalse kupriidina. Seda saab kunstlikult saada vask(II)soola lahuse kuumutamisel leelise ja mõne tugeva redutseerijaga, näiteks formaldehüüdi või glükoosiga. Vask(I)oksiid ei reageeri veega. Vask(I)oksiid viiakse kontsentreeritud vesinikkloriidhappe lahusesse, moodustades kloriidikompleksi:
Cu 2 O+4 HCl→2 H[ CuCl2]+ H 2 O
Lahustub ka ammoniaagi ja ammooniumisoolade kontsentreeritud lahuses:
Cu 2 O+2NH 4 + →2 +
Lahjendatud väävelhappes jaguneb see kahevalentseks vaseks ja metalliliseks vaseks:
Cu 2 O+H 2 NII 4 (lahjendatud) →CuSO 4 +Cu 0 ↓+H 2 O
Samuti osaleb vask(I)oksiid vesilahustes järgmistes reaktsioonides:
1. Hapniku toimel aeglaselt oksüdeeritud vask(II)hüdroksiidiks:
2 Cu 2 O+4 H 2 O+ O 2 →4 Cu(Oh) 2 ↓
2. Reageerib lahjendatud vesinikhalogeniidhapetega, moodustades vastavad vask(I)halogeniidid:
Cu 2 O+2 HГ→2CuГ↓ +H 2 O(G=Cl, Br, J)
3. Redutseeritud metalliliseks vaseks tüüpiliste redutseerivate ainetega, näiteks naatriumvesiniksulfit kontsentreeritud lahuses:
2 Cu 2 O+2 NaSO 3 →4 Cu↓+ Na 2 NII 4 + H 2 NII 4
Vask(I)oksiid redutseeritakse vaskmetalliks järgmistes reaktsioonides:
1. Kuumutamisel temperatuurini 1800 °C (laguneb):
2 Cu 2 O - 1800° C →2 Cu + O 2
2. Kuumutamisel vesiniku, süsinikmonooksiidi, alumiiniumi ja muude tüüpiliste redutseerivate ainetega:
Cu 2 O+H 2 - >250°C →2Cu +H 2 O
Cu 2 O+CO - 250-300 °C →2Cu +CO 2
3 Cu 2 O + 2 Al - 1000° C →6 Cu + Al 2 O 3
Samuti reageerib vask(I)oksiid kõrgel temperatuuril:
1. Ammoniaagiga (tekib vask(I)nitriid)
3 Cu 2 O + 2 N.H. 3 - 250° C →2 Cu 3 N + 3 H 2 O
2. Leelismetallioksiididega:
Cu 2 O+M 2 O- 600-800°C →2 MCuO (M = Li, Na, K)
Sel juhul moodustuvad vask (I) kupraadid.
Vask(I)oksiid reageerib märgatavalt leelistega:
Cu 2 O+2 NaOH (konts.) + H 2 O↔2 Na[ Cu(Oh) 2 ]
b) vaskhüdroksiid (I) CuOH
Vask(I)hüdroksiid moodustab kollase aine ja ei lahustu vees.
Kuumutamisel või keetmisel laguneb kergesti:
2 CuOH → Cu 2 O + H 2 O
c) HaliididCuF, CuKOOSl, CuBrJaCuJ
Kõik need ühendid on valged kristalsed ained, mis lahustuvad vees halvasti, kuid lahustuvad hästi NH3 liias, tsüaniidioonides, tiosulfaadioonides ja teistes tugevates kompleksimoodustajates. Jood moodustab ainult ühendi Cu +1 J. Gaasilises olekus tekivad (CuГ) 3 tüüpi tsüklid. Pöörduvalt lahustuv vastavates vesinikhalogeniidhapetes:
CuG + HG ↔H[ CuG 2 ] (Г=Cl, Br, J)
Vask(I)kloriid ja bromiid on niiskes õhus ebastabiilsed ja muutuvad järk-järgult aluselisteks vask(II)sooladeks:
4 CuG +2H 2 O + O 2 →4 Cu(Oh)G (G = Cl, Br)
d) muud vaseühendid (I)
1. Vask (I) atsetaat (CH 3 COOCu) on vaseühend, mis ilmub värvitute kristallidena. Vees hüdrolüüsub aeglaselt Cu 2 O-ks, õhus oksüdeerub vaskatsetaadiks; CH3COOCu saadakse (CH3COO)2Cu redutseerimisel vesiniku või vasega, (CH3COO)2Cu sublimeerimisel vaakumis või (NH3OH)SO4 interaktsioonil (CH3COO)2Cu-ga lahus H 3 COONH 3 juuresolekul. Aine on mürgine.
2. Vask(I)atsetüliid – punakaspruunid, vahel mustad kristallid. Kuivanud kristallid plahvatavad löömisel või kuumutamisel. Märjana stabiilne. Kui detonatsioon toimub hapniku puudumisel, ei teki gaasilisi aineid. Laguneb hapete mõjul. Moodustub sadena atsetüleeni suunamisel vask(I) soolade ammoniaagi lahustesse:
KOOS 2 H 2 +2[ Cu(N.H. 3 ) 2 ](Oh) → Cu 2 C 2 ↓ +2 H 2 O+2 N.H. 3
Seda reaktsiooni kasutatakse atsetüleeni kvalitatiivseks tuvastamiseks.
3. Vasknitriid - anorgaaniline ühend valemiga Cu 3 N, tumerohelised kristallid.
Kuumutamisel laguneb:
2 Cu 3 N - 300° C →6 Cu + N 2
Reageerib ägedalt hapetega:
2 Cu 3 N +6 HCl - 300° C →3 Cu↓ +3 CuCl 2 +2 N.H. 3
§3. Kahevalentse vase keemilised omadused (st. ok. = +2)
Vasel on kõige stabiilsem oksüdatsiooniaste ja see on sellele kõige iseloomulikum.
a) vaskoksiid (II) CuO
CuO on kahevalentse vase peamine oksiid. Kristallid on musta värvi, tavatingimustes üsna stabiilsed ja vees praktiliselt lahustumatud. Looduses esineb seda musta mineraali tenoriidina (melakoniidina). Vask(II)oksiid reageerib hapetega, moodustades vastavad vask(II)soolad ja vesi:
CuO + 2 HNO 3 → Cu(EI 3 ) 2 + H 2 O
Kui CuO sulatatakse leelistega, moodustuvad vask(II)kuraadid:
CuO+2 KOH- t ° → K 2 CuO 2 + H 2 O
Kuumutamisel temperatuurini 1100 °C laguneb:
4 CuO- t ° →2 Cu 2 O + O 2
b) Vask(II)hüdroksiidCu(Oh) 2
Vask(II)hüdroksiid on sinine amorfne või kristalne aine, vees praktiliselt lahustumatu. Kuumutamisel temperatuurini 70–90 °C laguneb Cu(OH)2 pulber või selle vesisuspensioonid CuO-ks ja H2O-ks:
Cu(Oh) 2 → CuO + H 2 O
See on amfoteerne hüdroksiid. Reageerib hapetega, moodustades vee ja vastava vasesoola:
See ei reageeri leeliste lahjendatud lahustega, vaid lahustub kontsentreeritud lahustes, moodustades helesinised tetrahüdroksükupraad (II):
Vask(II)hüdroksiid moodustab nõrkade hapetega aluselisi sooli. Lahustub väga kergesti liigses ammoniaagis, moodustades vase ammoniaagi:
Cu(OH) 2 +4NH 4 OH → (OH) 2 +4H 2 O
Vase ammoniaagil on intensiivne sinakasvioletne värvus, seetõttu kasutatakse seda analüütilises keemias väikeste Cu 2+ ioonide koguse määramiseks lahuses.
c) vase soolad (II)
Vase (II) lihtsoolad on tuntud enamiku anioonide jaoks, välja arvatud tsüaniid ja jodiid, mis Cu 2+ katiooniga interakteerudes moodustavad kovalentseid vase (I) ühendeid, mis on vees lahustumatud.
Vase (+2) soolad lahustuvad peamiselt vees. Nende lahuste sinine värvus on seotud 2+ iooni moodustumisega. Sageli kristalliseeruvad nad hüdraatidena. Seega kristalliseerub vask(II)kloriidi vesilahuses temperatuuril alla 15 0 C tetrahüdraat, temperatuuril 15-26 0 C - trihüdraat, üle 26 0 C - dihüdraat. Vesilahustes on vask(II) soolad kergelt hüdrolüüsitud ja nendest sadestuvad sageli aluselised soolad.
1. Vask(II)sulfaatpentahüdraat (vasksulfaat)
Suurim praktiline tähtsus on CuSO 4 * 5H 2 O, mida nimetatakse vasksulfaadiks. Kuiv sool on sinist värvi, kuid kergelt kuumutamisel (200 0 C) kaotab see kristallisatsioonivee. Veevaba sool on valge. Edasisel kuumutamisel temperatuurini 700 0 C muutub see vaskoksiidiks, kaotades vääveltrioksiidi:
CuSO 4 -- t ° → CuO+ NII 3
Vasksulfaat valmistatakse vase lahustamisel kontsentreeritud väävelhappes. Seda reaktsiooni kirjeldatakse jaotises "Lihtaine keemilised omadused". Vasksulfaati kasutatakse vase elektrolüütiliseks tootmiseks, põllumajanduses kahjurite ja taimehaiguste tõrjeks ning muude vaseühendite tootmiseks.
2. Vask(II)kloriiddihüdraat.
Need on vees kergesti lahustuvad tumerohelised kristallid. Vaskkloriidi kontsentreeritud lahused on rohelised ja lahjendatud lahused on sinised. Seda seletatakse rohelise kloriidikompleksi moodustumisega:
Cu 2+ +4 Cl - →[ CuCl 4 ] 2-
Ja selle edasine hävitamine ja sinise veekompleksi moodustumine.
3. Vask(II)nitraattrihüdraat.
Sinine kristalne aine. See saadakse vase lahustamisel lämmastikhappes. Kuumutamisel kaotavad kristallid kõigepealt vett, seejärel lagunevad hapniku ja lämmastikdioksiidi vabanemisega, muutudes vask(II)oksiidiks:
2Cu(NO 3 ) 2 -- t° →2CuO+4NO 2 +O 2
4. Hüdroksüvask(II)karbonaat.
Vaskkarbonaadid on ebastabiilsed ja neid praktiliselt ei kasutata. Vase tootmisel on teatud tähtsusega ainult aluseline vaskkarbonaat Cu 2 (OH) 2 CO 3, mis esineb looduses mineraalse malahhiidi kujul. Kuumutamisel laguneb see kergesti, eraldades vett, süsinikmonooksiidi (IV) ja vaskoksiidi (II):
Cu 2 (OH) 2 CO 3 -- t° →2CuO+H 2 O+CO 2
§4. Kolmevalentse vase keemilised omadused (st. ok. = +3)
See oksüdatsiooniaste on vase puhul kõige vähem stabiilne ja seetõttu on vask(III) ühendid pigem erand kui "reegel". Mõned kolmevalentsed vaseühendid on siiski olemas.
a) Vask(III)oksiid Cu 2 O 3
See on tumeda granaadi värvusega kristalne aine. Ei lahustu vees.
See saadakse vask(II)hüdroksiidi oksüdeerimisel kaaliumperoksodisulfaadiga leeliselises keskkonnas negatiivsetel temperatuuridel:
2Cu(OH) 2 +K 2 S 2 O 8 +2KOH -- -20°C → Cu 2 O 3 ↓+2K 2 NII 4 +3H 2 O
See aine laguneb temperatuuril 400 0 C:
Cu 2 O 3 -- t ° →2 CuO+ O 2
Vask(III)oksiid on tugev oksüdeerija. Vesinikkloriidiga reageerimisel redutseeritakse kloor vabaks klooriks:
Cu 2 O 3 +6 HCl-- t ° →2 CuCl 2 + Cl 2 +3 H 2 O
b) vaskkuraadid (C)
Need on mustad või sinised ained, vees ebastabiilsed, diamagnetilised, anioon on ruutude lint (dsp 2). Moodustub vask(II)hüdroksiidi ja hüpokloriti koosmõjul leelismetall leeliselises keskkonnas:
2 Cu(Oh) 2 + MClO + 2 NaOH→ 2 miljonitCuO 3 + NaCl +3 H 2 O (M= Na- Cs)
c) kaaliumheksafluorokupraat (III)
Roheline aine, paramagnetiline. Oktaeedriline struktuur sp 3 d 2. Vaskfluoriidi kompleks CuF 3, mis vabas olekus laguneb -60 0 C juures. Tekib kaalium- ja vaskkloriidide segu kuumutamisel fluoriatmosfääris:
3KCl + CuCl + 3F 2 → K 3 + 2Cl 2
Lagundab vett, moodustades vaba fluori.
§5. Oksüdatsiooniastmes vaseühendid (+4)
Teadus teab seni vaid ühte ainet, kus vask on oksüdatsiooniastmes +4, see on tseesiumheksafluorokupraat(IV) - Cs 2 Cu +4 F 6 - oranž kristalne aine, klaasampullides stabiilne temperatuuril 0 0 C. See reageerib ägedalt veega. See saadakse tseesiumi- ja vaskkloriidide segu fluorimisel kõrgel rõhul ja temperatuuril:
CuCl 2 +2CsCl +3F 2 -- t ° r → Cs 2 CuF 6 +2Cl 2